聯系電話
- 聯系人:
- 蘇小姐
- 電話:
- 400-820-3556
- 手機:
- 18521301252
- 地址:
- 上海市浦東新區環科路999弄浦東國際人才港13號樓2樓
掃一掃訪問手機商鋪
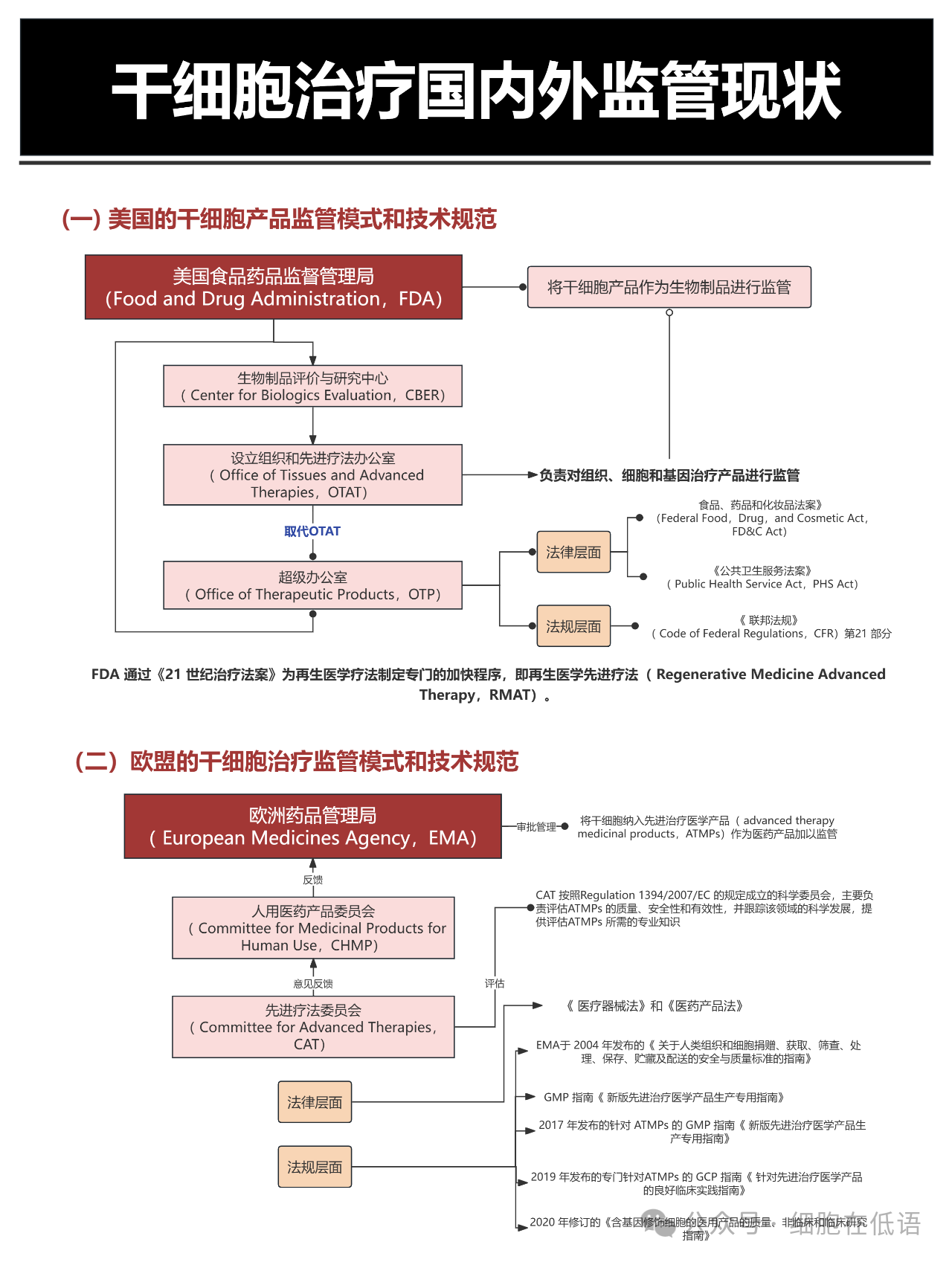
本文聚焦干細胞治療這一前沿醫療領域的國內外監管現狀,深入解析美國、歐盟、日本、中國四國的監管體系特點。在美國,食品藥品監督管理局(FDA)將干細胞明確歸類為生物制品,通過 “再生醫學先進療法"(RMAT)加速程序,在保障安全性的前提下縮短創新療法的審批周期。歐盟則由歐洲藥品管理局(EMA)主導,將干細胞治療納入先進治療醫學產品(ATMPs)框架,聯合細胞治療委員會(CAT)等專業機構開展多維度評估,強調技術創新性與臨床價值的平衡。
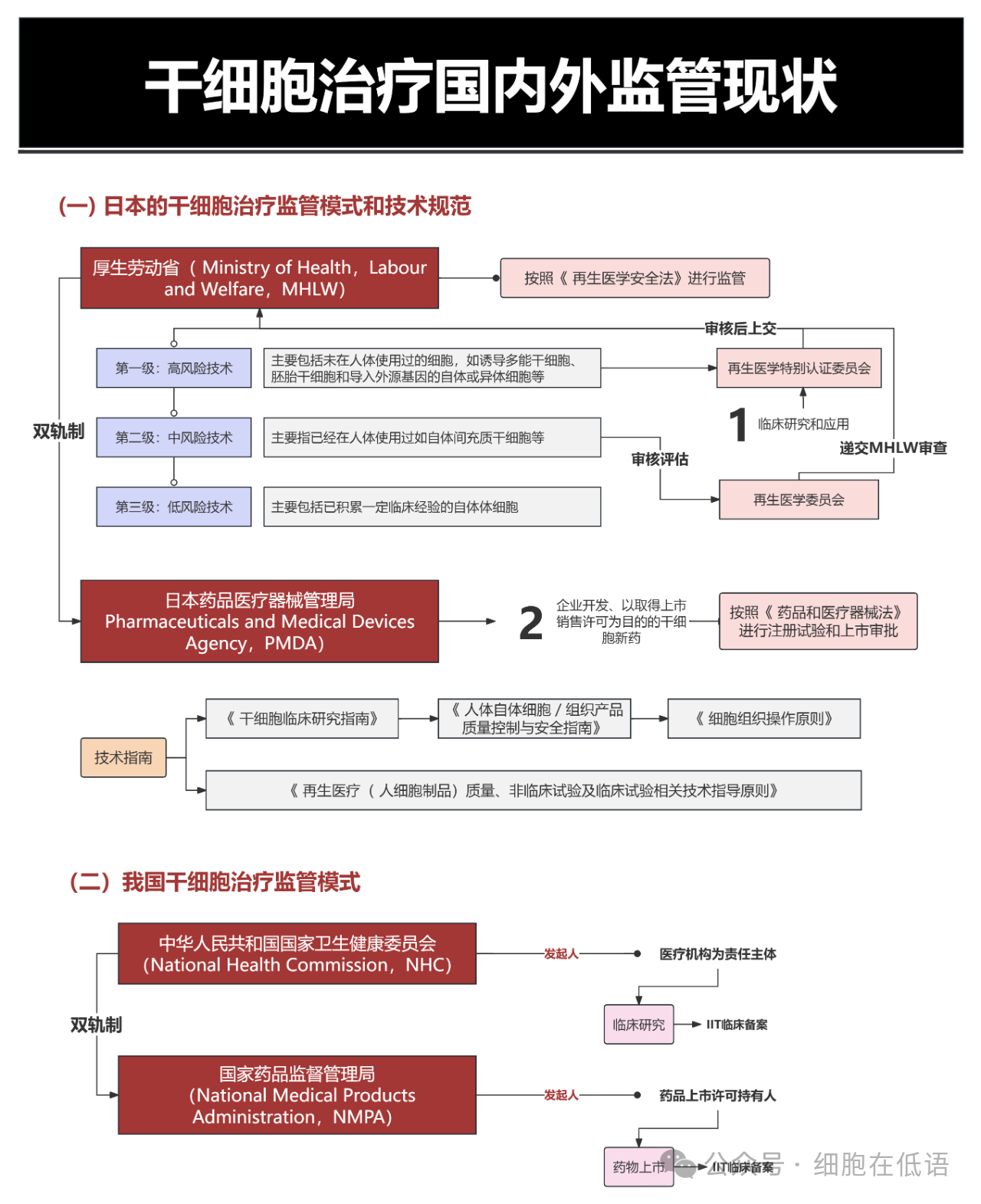
日本采用厚生勞動省與藥品和醫療器械局(PMDA)的雙軌監管模式,根據干細胞療法的風險等級實施分級管控,為再生醫學發展提供靈活空間。我國實行國家衛生健康委員會(NHC)負責臨床研究審批、國家藥品監督管理局(NMPA)主管藥物上市許可的雙軌制,清晰劃分醫療機構與藥企的責任邊界。盡管各國監管路徑各有側重,但均以規范行業發展、保障患者權益為核心,共同推動干細胞治療向標準化、產業化方向邁進。

 中級會員·6年
中級會員·6年
