靶向PIEZO1-GRHL3-RNF114機械通路增強T細胞牽引力與腫瘤殺傷功能
研究背景
免疫檢查點阻斷(ICB)療法(如抗PD-1)對多種癌癥有效,但療效有限,亟需探索T細胞功能的調控機制。
T細胞機械生物學新興領域:T細胞通過機械力感知腫瘤微環境,但具體機制不清。
關鍵發現
1. PIEZO1抑制增強T細胞殺傷功能
體外實驗:PIEZO1拮抗劑(GsMTx4)或基因敲低(shRNA)顯著增強CTLs對黑色素瘤(B16)和結腸癌(MC38)細胞的殺傷能力,且不依賴傳統細胞因子(IFN-γ/TNF)或穿孔素/顆粒酶通路。
機制:通過增強T細胞與腫瘤細胞的牽引力(由F-肌動蛋白調控),促進穿孔素介導的孔形成和脫顆粒(CD107a↑)。
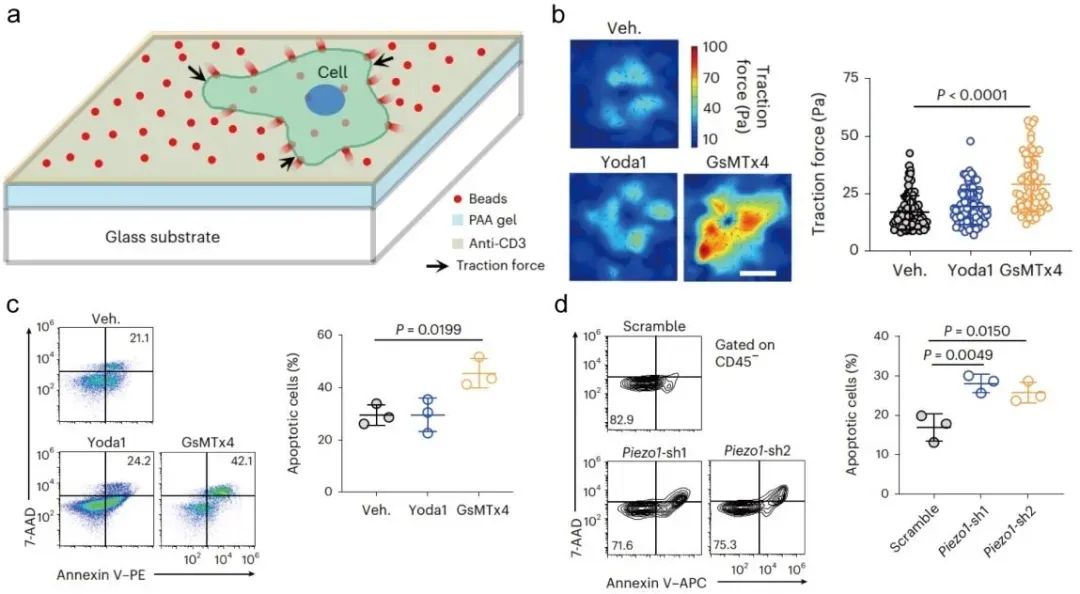
圖1. PIEZO1阻斷增強T細胞牽引力及腫瘤殺傷效能。a) T細胞牽引力檢測示意圖。b) 小分子藥物阻斷PIEZO1增強T細胞牽引力。c, d)小分子藥物阻斷(c)和shRNA(d)敲減PIEZO1增強T細胞的腫瘤殺傷效果
2. 信號通路:PIEZO1-GRHL3-RNF114-F-肌動蛋白軸
PIEZO1激活→上調轉錄因子GRHL3→誘導E3泛素連接酶RNF114→降解F-肌動蛋白→減弱牽引力→抑制CTLs殺傷活性。
阻斷PIEZO1可逆轉這一過程,恢復T細胞的機械殺傷力。
3. 體內驗證與臨床意義
小鼠模型:PIEZO1抑制的CTLs顯著抑制腫瘤生長,延長生存期,且與抗PD-1療法聯用效果更強。
患者數據:
癌癥患者(結直腸癌、胃癌、肝癌)的CD8?T細胞中,PIEZO1/GRHL3/RNF114表達升高,但牽引力降低。
GRHL3/RNF114高表達與ICB治療預后差及CD8?T細胞浸潤減少顯著相關。
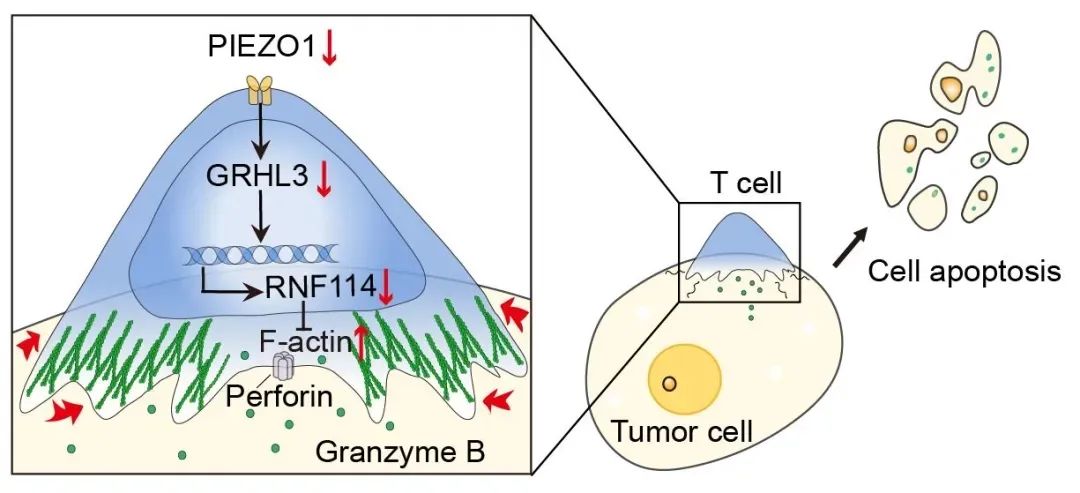
圖2. PIEZO1-GRHL3-RNF114信號通路調控T細胞腫瘤殺傷的力學生物學機制
治療潛力
靶向PIEZO1(如GsMTx4)或GRHL3/RNF114可增強T細胞的機械殺傷力和腫瘤浸潤,克服ICB耐藥。
聯合療法:PIEZO1抑制劑與抗PD-1聯用,顯著提升療效。
研究意義
闡明機械力調控T細胞抗腫瘤功能的分子機制,提出**“免疫-力學聯合治療”**新范式。
為優化過繼性T細胞療法和ICB提供生物標志物(GRHL3/RNF114表達)和干預靶
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號



















 采購中心
采購中心